Skuteczność zarybień materiałem wyhodowanym w warunkach akwakultury zależy od wielu czynników; antropogennych, środowiskowych i osobniczych. Wśród tych ostatnich ogromne znaczenie ogrywa sprawne funkcjonowanie układu immunologicznego ryby. Wsiedlanie do nowego środowiska oznacza spotkanie z całkowicie nowym zestawem potencjalnie chorobotwórczych drobnoustrojów. Ze względu na zmienność warunków środowiskowych, skład gatunkowy mikroflory i mikrofauny wód jest nieprzewidywalny, co z kolei uniemożliwia zastosowanie szczepień w celu uodpornienia ryb. Co więcej, stres wywołany wprowadzeniem do nowego środowiska zwykle skutkuje u ryb rozpadem limfocytów i osłabieniem odporności swoistej a tym samym stawia pod znakiem zapytanie skuteczność potencjalnych szczepień ochronnych.
Z powyższych powodów, niezwykle istotne znaczenie odgrywa poziom odporności nieswoistej ryb przeznaczonych do zarybień. Za nieswoistą obronę organizmu odpowiedzialne są w pierwszy rzędzie obecne w organizmie ryby makrofagi (granulocyty obojętnochłonne, monocyty, makrofagi tkankowe) ale również inne komórki jak trombocyty czy niektóre komórki nabłonkowe. Makrofagi odpowiedzialne są za proces fagocytozy czyli pochłaniania i niszczenia potencjalnie niebezpiecznych mikroorganizmów. Zidentyfikowano także szereg nieswoiście działających białek odpornościowych a wśród nich białka układu dopełniacza, defenzyny, laktoferynę i inne. Mechanizmy odporności nieswoistej mogą działać bezpośrednio po zetknięciu z czynnikiem chorobotwórczym i często wystarczają do jego eliminacji. Co więcej, sprawnie działający układ odporności nieswoistej umożliwia szybsze uruchomienie mechanizmów odporności swoistej.
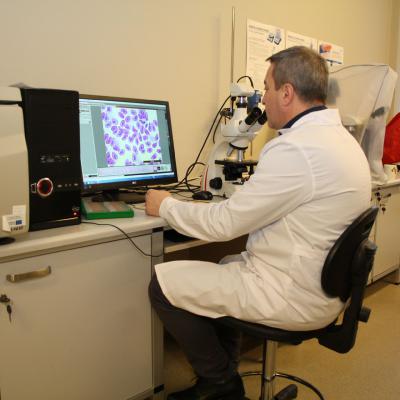
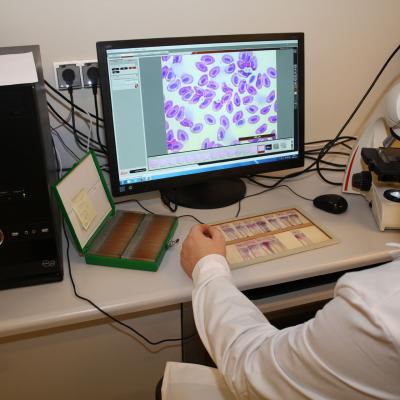
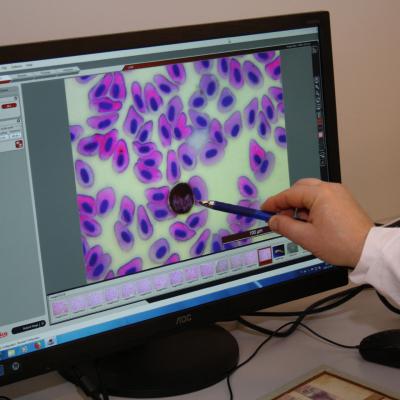
W projekcie REGA , poziom odporności nieswoistej pstrągów i troci badano za pomocą oceny aktywności specyficznego enzymu obecnego w ziarnistościach granulocytów i monocytów – mieloperoksydazy (MPO). Aktywność tego enzymu jest proporcjonalna do tzw. „wybuchu tlenowego” – czyli produkcji dużej ilości „żrących” wolnych rodników, która zachodzi w makrofagach i ma na celu zniszczenie pochłoniętych drobnoustrojów. W celu zbadania aktywności MPO, od badanych ryb pobrano próby krwi, z których wykonano rozmazy na szkiełkach podstawowych. Rozmazy te poddano wieloetapowemu barwieniu cytochemicznemu, którego kluczowy etap stanowiła inkubacja w obecności diaminobenzydyny (DAB) oraz nadtlenku wodoru. Pod wpływem MPO, diaminobenzydyna zostaje utleniona i przyjmuje brązowe zabarwienie, które w następnych etapach barwienia cytochemicznego zmienia się na szaro-czarne. W ten sposób obecne w makrofagach ziarnistości zawierające MPO są wybarwione na kolor od szarego do czarnego. W zależności od siły zabarwienia, wielkości i rozległości granul, wyodrębniono 4 stopnie aktywności MPO; od braku aktywności (stopień 0) po silną aktywność (stopień 3).
Aby uaktywnić zawartą w ziarnistościach makrofagów MPO, przed wykonaniem rozmazów krew inkubowano z zawiesiną zymosanu – drobinami o niewielkiej średnicy pochodzącymi ze ścian drożdży silnie, pobudzającymi proces fagocytozy. Odpowiedź fagocytarna makrofagów (czyli średnia liczba pochłoniętych ziaren zymosanu oraz odsetek makrofagów, które podjęły fagocytozę) jest również dobrym miernikiem odporności nieswoistej.
Zastosowany system barwienia umożliwił odróżnienie poszczególnych typów krwinek białych (leukocytów); limfocytów, neutrofili, eozynofilii, bazofili, monocytów i trombocytów. Podobnie jak u człowieka, struktura populacji krwinek białych (tzw. leukogram) jest rutynowym wskaźnikiem mówiącym o stanie odporności badanych ryb.